بیماری های ژنتیکی کبد بیماری هایی هستند که از والدین یا یکی از اعضای خانواده به ارث میرسند. از طرفی هم بیماری های ژنتیکی به دلیل جهش (تغییر در ساختار) DNA ایجاد میشوند. جهش زاها موادی هستند که در مواجهه با برخی از مواد شیمیایی مانند مواد شیمیایی موجود در پخت غذا یا غذاهای سرخ شده، اشعه ماوراء بنفش (تابش خورشید یا منابع مصنوعی)، یا اشعه ایکس (تابش اشعه ایکس که در حین گرفتن عکس ایکس قرار میگیرد) باعث جهش ژن میشود. بسیاری از بیماری هایی که کبد را درگیر میکنند ممکن است جنبه ژنتیکی داشته باشند.
هر یک از بیماری ها علائم و علل جانبی خاصی دارند. تشخیص و گزینه های درمان بیماری های ژنتیکی کبد با توجه به نوع آنها متفاوت است. برهمین اساس ما سعی کرده ایم در این مقاله از پزشکت، انواع بیماری های ژنتیکی کبد را مورد بررسی قرار دهیم.
شایع ترین بیماری های ژنتیکی کبد
 هموکروماتوز
هموکروماتوز
هموکروماتوز ذخیره بیش از حد آهن در کبد ناشی از مواد غذایی مصرفی فرد است. این یک بیماری ارثی ژنتیکی است و منجر به جذب بالای کبد از غذا میشود. علت آن جهش در ژن HFE (تنظیم کننده آهن هموستاتیک) است که جذب آهن از غذا را کنترل میکند. این ژن به ارث رسیده یا از والدین گرفته شده است. اگر هر دو ژن HFE از والدین غیرطبیعی باشند، احتمال ابتلا به هموکروماتوز زیاد است. اگر یک ژن HFE غیرطبیعی باشد، ممکن است فرد به هموکروماتوز مبتلا شود و ناقل باشد و این ژن غیرطبیعی را به فرزندان خود منتقل کند.
علائم احتمالی ناشی از بیماری هموکروماتوز، عبارتند از:
- درد مفاصل
- نارسایی قلبی
- درد در ناحیه شکم
- احساس ضعف و خستگی
- از دست دادن میل جنسی
- رنگ پوست به رنگ برنزی تغییر میکند.
تشخیص هموکروماتوز چگونه انجام می شود؟
بدون شک پزشک میتواند برای تشخیص این بیماری از روش های مختلف زیر استفاده کند:
- فریتین سرم: این آزمایش میزان آهن ذخیره شده در کبد را نشان میدهد.
- میزان اشباع ترانسفرین سرم: این آزمایش میزان آهن گیر کرده با پروتئینی به نام ترانسفرین را نشان میدهد. این ترانسفرین آهن را در خون حمل میکند.
- تستهای عملکرد کبد: تستهای عملکرد کبد، آزمایشهای خونی هستند که آنزیمهای کبدی، پروتئینها و زمان پروترومبین را بررسی میکنند. آنزیم های کبدی مانند آلکالین فسفاتاز (ALP)، آلانین ترانس آمیناز (ALT)، آسپارتات ترانس آمیناز (AST)، گاما گلوتامیل ترانس آمیناز (GGT) و پروتئین هایی مانند آلبومین و گلوبولین برای تشخیص بیماری کبدی غربالگری میشوند. تغییرات در مقادیر طبیعی این آنزیم ها و پروتئین ها نشان دهنده بیماری کبدی است.
- آزمایش جهش ژنی: آزمایش جهش ژنی برای HFE در صورتی انجام میشود که سطح آهن در خون برای رد هموکروماتوز بسیار بالا باشد.
- اسکن MRI: اسکن رزونانس مغناطیسی (MRI) از ترکیبی از میدان های مغناطیسی قوی و امواج رادیویی برای گرفتن تصاویری از اندام ها و ساختارهای داخلی استفاده میکند. این تکنیک نمای دقیقی از ساختار کبد را به پزشک ارائه میدهد.
- بیوپسی کبد: بیوپسی کبد بخش کوچکی از بافت کبد را برای مشاهده تغییرات پاتولوژیک در نمای میکروسکوپی حذف میکند. این یک آزمایش تاییدی است و نوع بیماری کبدی را نشان میدهد.
هموکروماتوز چگونه درمان میشود؟
هموکروماتوز با حذف خون از طریق سیاهرگ ها درمان میشود. این روش درمان برای کاهش آهن موجود در خون انجام میشود. این روش در ابتدا یک تا دو بار در هفته انجام خواهد شد. سپس زمانی که سطح آهن طبیعی باشد، خون گیری هر دو تا سه ماه یکبار انجام میشود. در برخی موارد، اگر بیمار مبتلا به کم خونی (کاهش گلبول های قرمز سالم در خون) یا بیماران مبتلا به بیماری های قلبی باشد، برداشتن خون میتواند منجر به عوارض شود. در این نوع بیماران دارویی که آهن اضافی خون را خارج میکند تزریق یا خوراکی میشود. آهن اضافی را از طریق ادرار یا مدفوع دفع میکند و به این حالت شلیت میگویند.
کمبود آلفا 1 آنتی تریپسین (AAT)
آلفا 1 آنتی تریپسین پروتئینی است که از ریه محافظت میکند و توسط کبد تولید میشود. در بیماران مبتلا به بیماری ژنتیکی AAT، کمبود آنتی تریپسین آلفا-1 منجر به آسیب کبد و ریه میشود. پروتئین آلفا-1 آنتی تریپسین عملکرد آنزیم نوتروفیل استراز را کنترل میکند. این آنزیم توسط گلبولهای سفید خون برای مبارزه با عفونتها آزاد میشود، اما اگر توسط آلفا-1 آنتیتریپسین محدود نشود، به بافتهای طبیعی نیز آسیب میرساند.
ژن سرپینا 1 اطلاعاتی را برای تشکیل آلفا-1 آنتی تریپسین فراهم میکند. جهش در سرپینا 1 باعث کمبود آلفا-1 آنتی تریپسین میشود و آنزیم های نوتروفیل استراز از کنترل خارج میشوند. این آنزیم ها به بافت های ریه آسیب میرسانند و باعث آسیب ریه میشوند. این همچنین باعث تجمع آلفا-1 آنتی تریپسین در کبد و آسیب کبدی میشود.
علائم AAT چیست؟
علائم کمبود آلفا 1 آنتی تریپسین میتواند شامل موارد زیر شود:
- خس خس سینه
- احساس ضعف و خستگی
- تنگی نفس در حداقل کار
- عفونت های تنفسی مکرر
- کاهش وزن غیر قابل توضیح
- آمفیزم (آسیب به کیسه های کوچک پر از هوا به نام آلوئول)
کمبود آلفا 1 آنتی تریپسین چگونه تشخیص داده می شود؟
پزشک ممکن است برای تشخیص بیماری کمبود آنتی تریپسین آلفا-1 آزمایشات زیر را تجویز کند:
- آزمایش خون: آزمایش خون برای غربالگری سطح AAT در خون انجام میشود. اگر سطوح پایین تر از محدوده طبیعی باشد، کمبود AAT تشخیص داده میشود.
- آزمایش ژنتیک: در صورت خطر بروز بیماری در فرد، آزمایش ژنتیکی برای تعیین جهش AAT انجام میشود.
- اسپیرومتری: این یک تست عملکرد ریه را برای تعیین میزان دم و بازدم سریع فرد اندازه گیری میکند.
- سی تی اسکن قفسه سینه: توموگرافی کامپیوتری (CT) یک تکنیک تصویربرداری است که شامل تصاویر اشعه ایکس مقطعی از ریه ها در زوایای مختلف است که به صورت دیجیتالی روی کامپیوتر گرفته شده است.
چگونه کمبود آلفا-1 آنتی تریپسین درمان میشود؟
هیچ درمان خاصی برای کمبود آلفا-1 آنتی تریپسین وجود ندارد، اما درمان جایگزین میتواند شرایط ریه بیمار را تا حدودی بهبود بخشد. یکی از گزینه های درمان جایگزین، درمان تقویتی است.
درمان تقویتی یا جایگزینی، شامل جایگزینی آنتی تریپسین آلفا-1 از خون اهداکننده است. خون از اهداکننده به بیمار مبتلا به کمبود آلفا-1 آنتی تریپسین از طریق وریدها منتقل میشود. آلفا-1 آنتی تریپسین کاهش یافته جایگزین خواهد شد. این باعث کاهش آسیب ریه و کبد میشود.
 بیماری ویلسون
بیماری ویلسون
بیماری ویلسون تجمع غیرطبیعی مس در کبد و یک بیماری ژنتیکی است که از حذف مس اضافی توسط بدن جلوگیری میکند. سطوح بالای مس میتواند باعث آسیب های خطرناک و جدی به اندام های بدن شود. بیماری ویلسون باعث آسیب کبدی میشود که میتواند به تدریج پیشرونده یا حاد و بسیار شدید باشد.
کبد مواد زائد، سموم و سایر عناصر مانند مس را از طریق صفرا و دستگاه گوارش دفع میکند. با این حال، جهش ژن ATP 7 از حذف کامل مس از کبد جلوگیری میکند. این حذف ناقص منجر به ذخیره بیش از حد مس در کبد میشود که با بروز علائم زیر همراه است:
- سفتی عضلات
- احساس ضعف و خستگی
- تغییر رنگ مایل به زرد در پوست و چشم
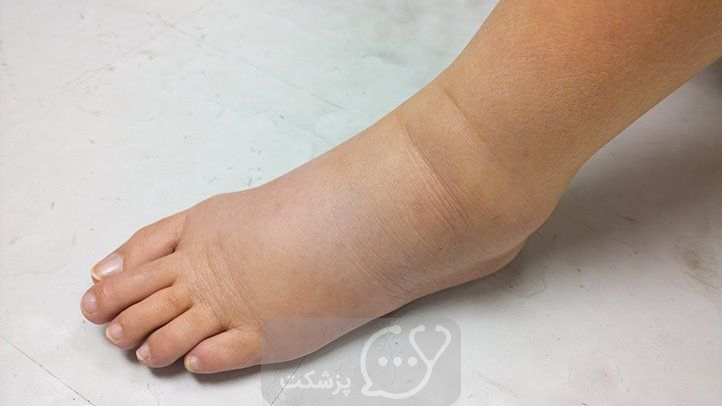
- ادم (تورم در پاها به دلیل تجمع مایعات)
- آسیت (بزرگ شدن معده به دلیل تجمع مایعات)
- تغییر رنگ طلایی-قهوه ای چشم (حلقه Kayser-Fleischer)
بیماری ویلسون چگونه تشخیص داده می شود؟
پزشک معالج شما میتواند برای تشخیص بیماری ویلسون، آزمایشات زیر را تجویز کند:
معاینه فیزیکی: معاینه فیزیکی توسط پزشک برای بررسی بزرگی کبد، تورم یا درد در معده و تورم در پاها انجام میشود.
معاینه چشم: برای بررسی حلقه Kayser-Fleischer در چشم از نور مخصوصی استفاده میشود.
آزمایش خون: آزمایش خون برای غربالگری پروتئین سرولوپلاسمین که مس را در گردش خون حمل میکند، انجام میشود.
پیشنهـاد متخصص
بیش از ۳۲۱ نفر برای این مطلب با متخصصان زیر گفتگو کرده اند!
آزمایش نمونه ادرار: این آزمایش برای غربالگری وجود مس در ادرار انجام میشود.
تستهای عملکرد کبد:
تستهای عملکرد کبد گروهی از آزمایشها هستند که شامل غربالگری آنزیمهای کبدی، پروتئینها و زمان پروترومبین میشوند. آنزیم های کبدی مانند آلکالین فسفاتاز (ALP)، آلانین ترانس آمیناز (ALT)، آسپارتات ترانس آمیناز (AST)، گاما گلوتامیل ترانس آمیناز (GGT) و پروتئین هایی مانند آلبومین و گلوبولین برای تشخیص بیماری کبدی غربالگری میشوند. تغییرات در مقادیر طبیعی این آنزیم ها و پروتئین ها نشان دهنده بیماری کبدی است.
سی تی اسکن: توموگرافی کامپیوتری (CT) مجموعه ای از تصاویر اشعه ایکس است که از زوایای مختلف بدن گرفته میشود. این یک تصویر دقیق از ساختارهای گرفته شده ارائه میدهد. سی تی اسکن به تشخیص بیماری کبد کمک میکند.
اسکن MRI: تصویربرداری رزونانس مغناطیسی (MRI) از ترکیب یک میدان مغناطیسی قوی و امواج رادیویی با فرکانس بالا برای ثبت ساختارهای داخلی بدن ما استفاده میکند. این اسکن تصویر دقیق تری از ساختار برای کشف بیماری ارائه میدهد.
بیوپسی کبد: بیوپسی کبد شامل برداشتن بخش بسیار کوچکی از بافت کبد برای مشاهده تغییرات در سطح میکروسکوپی است. نتیجه این آزمایش جزییات نوع بیماری را نشان میدهد. این یک تست تاییدی است.
با درمان مناسب و دارو، پیشرفت بیماری را میتوان متوقف کرد و اغلب علائم را میتوان بهبود بخشید یا از علائم جدید جلوگیری کرد. درمان بیماری ویلسون بسته به وضعیت بیمار ممکن است شامل موارد زیر باشد:
- داروها: داروهایی مانند روی تجویز میشود، زیرا از جذب مس در روده جلوگیری میکند.
- عوامل کیلیت: مواد کیلیت کننده مانند پنی سیامین تجویز میشود، زیرا به حذف مس اضافی از بدن کمک میکند.
سندرم گیلبرت
سندرم گیلبرت یک اختلال ارثی خفیف در کبد است که منجر به فراوانی بیش از حد ماده ای به نام بیلی روبین میشود. افراد مبتلا به سندرم گیلبرت دارای یک ناهنجاری ارثی هستند که باعث کاهش تولید آنزیمی که در پردازش بیلی روبین نقش دارد، میشود. در حالی که برخی از افراد مبتلا به سندرم گیلبرت دچار زردی پوست یا چشم (یرقان) میشوند، اکثر افراد اصلاً هیچ علامتی ندارند.
از آنجایی که اکثر بیماران مبتلا به سندرم گیلبرت هیچ علامتی ندارند. اغلب به طور تصادفی تشخیص داده میشود که یک آزمایش آزمایشگاهی به دلیل دیگری نشان دهنده سطح بالای بیلی روبین باشد. سندرم گیلبرت خطرناک نیست و مشکلات طولانی مدت ایجاد نمیکند، بنابراین نیازی به درمان ندارد.
تیروزینمی نوع 1
تیروزینمی نوع I تجمع غیر طبیعی آنزیم تیروزین در کبد است. این وضعیت به دلیل کمبود آنزیم فوماریل استواستات هیدرولاز (FAH) ایجاد میشود. این آنزیم به تجزیه نهایی تیروزینمی کمک میکند، که بلوک ساختمانی برای اکثر پروتئین ها است. این تجزیه ناموفق منجر به تجمع تیروزین در کبد میشود.
نوزادان مبتلا به نوع حاد تیروزینمی نوع I، تاخیر در رشد، طحال بزرگ شده غیرطبیعی (سپلنومگالی) و تجمع مایع (ادم) در شکم (آسیت) را تجربه میکنند. این اختلال ممکن است به سرعت به نارسایی حاد کبدی و ناهنجاری های لخته شدن خون (انعقاد خون) منجر شود
شکل مزمن تیروزینمی نوع I کمتر از شکل حاد رخ میدهد و با شروع تدریجی و بروز علائم کمتر مشخص میشود. علائم تیروزینمی نوع I ممکن است در نوزادان مبتلا به شکل مزمن این اختلال تا پس از شش ماهگی آشکار نشود. تاخیر در رشد اغلب اولین علامت است. سایر علائم شامل تأخیر در رشد و اسکار پیشرونده و اختلال در عملکرد کبد (سیروز) است که منجر به نارسایی مزمن کبد میشود.
 علائم تیروزینمی نوع 1معمولاً در عرض چند ماه پس از تولد رخ میدهند و عبارتند از:
علائم تیروزینمی نوع 1معمولاً در عرض چند ماه پس از تولد رخ میدهند و عبارتند از:
- تب
- اسهال
- استفراغ
- بزرگ شدن کبد
- کبودی و خونریزی آسان
- عدم افزایش وزن
- زردی (پوست و چشم به رنگ زرد به نظر میرسد).
تیروزینمی نوع 1 چگونه تشخیص و درمان می شود؟
پزشک معالج میتواند برای تیروزینمی نوع 1 روند تشخیصی زیر را انجام دهد:
- معاینه فیزیکی: معاینه فیزیکی توسط پزشک برای بررسی بزرگی کبد انجام میشود.
- آزمایش ادرار: آزمایش ادرار برای بررسی وجود تیروزین و سوکسینیل استون انجام میشود.
- آزمایش ژنتیک: آزمایش ژنتیکی برای تعیین جهش در FAH انجام میشود.
- بیوپسی کبد: بیوپسی کبد شامل برداشتن بخش بسیار کوچکی از بافت کبد برای مشاهده تغییرات در سطح میکروسکوپی است. نتیجه این آزمایش جزییات نوع بیماری را نشان میدهد. این یک تست تاییدی است.
درمان تیروزینمی نوع 1 میتواند شامل موارد زیر باشد:
- داروها: داروهایی مانند کپسول یا شربت Nitisinone تجویز میشود.
- رژیم غذایی: یک رژیم غذایی کم پروتئین همراه با دارو باید رعایت شود.
بیماری ذخیرهسازی گلیکوژن نوع 4
قند (گلوکز) از غذایی که مصرف میکنیم جذب میشود. بدن از قند برای انرژی استفاده میکند. قند اضافی موجود در گردش خون به شکل گلیکوژن در کبد ذخیره میشود تا بعدا استفاده شود. گلیکوژن در صورت نیاز بدن با کمک آنزیم های شاخه گلیکوژن (GBE) به گلوکز (قند) تجزیه میشود. آنزیم های GBE1 به تولید گلیکوژن دستور میدهند. جهش در GBE1 از تولید گلیکوژن جلوگیری میکند. این منجر به کمبود گلیکوژن میشود و مولکول های غیر طبیعی گلیکوژن تشکیل شده و در کبد ذخیره میشوند. این منجر به آسیب سلولی و مرگ سلولی میشود.
علائم بیماری ذخیره گلیکوژن نوع 4 میتواند شامل موارد زیر باشد:
- ضعف عضلانی
- عدم تحمل گرما
- کبودی آسان
- احساس ضعف و خستگی
- عدم رشد طبیعی
- سطح قند خون پایین
- بزرگ شدن کبد یا شکم
- درد عضلانی یا گرفتگی عضلات در حین انجام ورزش
بیماری نوع 4 ذخیره سازی گلیکوژن با انجام برخی آزمایشات زیر تشخیص داده میشود:
- آزمایش خون: آزمایش خون برای بررسی سطح قند خون انجام میشود.
- اولتراسوند شکم: یک موج صوتی با فرکانس بالا برای گرفتن تصاویری از ساختارها یا اندام های داخل بدن استفاده میشود.
- بیوپسی بافتی: بیوپسی بافتی شامل برداشتن قسمت بسیار کوچکی از بافت کبد یا بافت ماهیچه ای برای مشاهده تغییرات در سطح میکروسکوپی است. نتیجه این آزمایش جزییات نوع بیماری را نشان میدهد.
- آزمایش ژنتیک: یک آزمایش ژنتیکی برای تعیین جهش در GBE1 انجام میشود.
چگونه بیماری ذخیره گلیکوژن درمان میشود؟
پزشک ممکن است برای درمان این بیماری گزینه های درمان زیر را توصیه کند:
- مصرف منظم نشاسته نپخته: نشاسته خام یک کربوهیدرات پیچیده است که به سختی هضم میشود و برای مدت طولانی در سیستم باقی میماند و در نتیجه سطح قند خون طبیعی را در خون حفظ میکند.
- مکمل های غذایی مانند ویتامین ها و مواد معدنی
- پیوند کبد
عدم تحمل ارثی فروکتوز
عدم تحمل ارثی فروکتوز در صورت عدم درمان آنزیم آلدولاز B که برای تجزیه فروکتوز لازم است در فرد رخ میدهد. فروکتوز نوعی قند میوه است که به طور طبیعی در بدن ما وجود دارد. فروکتوز برای شیرین کردن بسیاری از مواد غذایی و در غذاهای کودک استفاده میشود. وقتی فردی غذاهای حاوی فروکتوز مصرف میکند، بدن نمیتواند گلیکوژن را به گلوکز تبدیل کند. این امر باعث کاهش سطح قند خون در خون و تجمع مواد مضر در کبد میشود.
این وضعیت زمانی رخ می دهد که بدن آنزیمی به نام آلدولاز B را از دست بدهد. بدن به این ماده برای تجزیه فروکتوز نیاز دارد.
اگر فردی بدون این ماده فروکتوز یا ساکارز (قند نیشکر یا چغندر، قند سفره) بخورد، تغییرات شیمیایی پیچیده ای در بدن ایجاد می شود. بدن نمی تواند شکل ذخیره شده قند (گلیکوژن) خود را به گلوکز تبدیل کند. در نتیجه قند خون کاهش می یابد و مواد خطرناک در کبد تجمع پیدا می کند و منجر به بروز برخی علائم در بیمار می شود.
عدم تحمل ارثی فروکتوز ارثی است، به این معنی که می تواند از طریق خانواده ها منتقل شود. اگر هر دو والدین دارای یک نسخه غیرفعال از ژن آلدولاز B باشند، هر یک از فرزندانشان 25 درصد (1 از 4) احتمال ابتلا به آن را دارند.
علائم تحمل ارثی فروکتوز
نشانه ها و علائم بیماری بعد از شروع خوردن غذا یا شیر خشک در نوزادان تشخیص داده می شود. علائم اولیه عدم تحمل فروکتوز مشابه علائم گالاکتوزمی (ناتوانی در استفاده از قند گالاکتوز) است و علائم بعدی بیشتر به بیماری کبد مربوط میشود. علائم عدم تحمل ارثی فروکتوز میتواند شامل موارد زیر باشد:
- استفراغ
- تاخیر در رشد
- تشنج
- کبد بزرگ شده
- گاهی اوقات بیهوش شدن
- خواب آلودگی بیش از حد
- تغییر رنگ مایل به زرد در پوست و چشم
عدم تحمل ارثی فروکتوز چگونه تشخیص داده می شود؟
تشخیص عدم تحمل ارثی فروکتوز از راه های زیر انجام میشود:
- آزمایش خون: در این شرایط آزمایش خون برای بررسی سطح قند خون انجام میشود.
- بیوپسی کبد: نتیجه این آزمایش جزییات نوع بیماری را نشان میدهد.
- معاینه فیزیکی: برای تشخیص این بیماری معاینه فیزیکی توسط پزشک برای بررسی بزرگی کبد انجام میشود.
- تست عملکرد کلیه: برای تشخیص این بیماری، تست عملکرد کلیه برای بررسی سطوح نیتروژن اوره خون، میزان فیلتراسیون گلومرولی تخمین زده شده (نرخ فیلتراسیون را بسته به سطح پروتئین، سن، جنسیت و اندازه تخمین میزند)، و کراتینین (سطح کراتینین خون را که یک محصول زائد تجزیه عضلانی است، نمایش میدهد) استفاده میشود.
- تستهای عملکرد کبد: به طور کلی، تستهای عملکرد کبد گروهی از آزمایشها هستند که شامل غربالگری آنزیمهای کبدی، پروتئینها و زمان پروترومبین میشوند. آنزیم های کبدی مانند آلکالین فسفاتاز (ALP)، آلانین ترانس آمیناز (ALT)، آسپارتات ترانس آمیناز (AST)، گاما گلوتامیل ترانس آمیناز (GGT) و پروتئین هایی مانند آلبومین و گلوبولین برای تشخیص بیماری کبدی غربالگری میشوند.
- آزمایش خون اسید اوریک: این آزمایش میزان اسید اوریک (یک ماده شیمیایی که به دلیل پردازش پورین ایجاد میشود) موجود در خون را تعیین میکند.
- آزمایش ادرار: این آزمایش برای بررسی فیزیکی، شیمیایی و میکروسکوپی اجزای موجود در ادرار انجام میشود.
حذف فروکتوز و ساکارز از رژیم غذایی یک درمان موثر برای اکثر افراد است. عوارض ممکن است درمان شوند. به عنوان مثال، برخی از افراد می توانند دارویی برای کاهش سطح اسید اوریک در خون و کاهش خطر ابتلا به نقرس مصرف کنند.
تعداد کمی از کودکان مبتلا به نوع شدید این بیماری به بیماری شدید کبدی مبتلا خواهند شد. حتی حذف فروکتوز و ساکارز از رژیم غذایی ممکن است از بیماری شدید کبدی در این کودکان جلوگیری نکند.
سخن آخر
بیماری های ژنتیکی کبد گروهی از نقایص متابولیکی و ژنتیکی هستند که به طور معمول باعث بیماری مزمن کبدی میشوند. آنها ممکن است در بستگان نزدیک کسانی که به آن بیماری ها مبتلا هستند یافت شوند.
بیماری های ژنتیکی در خانواده وجود دارد یا یکی از اعضای خانواده ممکن است تحت تأثیر این بیماری قرار گیرد. ژن حامل همین اطلاعات به نسل بعدی منتقل خواهد شد. اگر فرد نسل بعدی دارای دو ژن غیر طبیعی باشد، فرد به بیماری ژنتیکی کبدی مبتلا میشود. اگر فرد فقط یک ژن غیر طبیعی داشته باشد، ممکن است ناقل باشد و بیماری را به نسل بعدی منتقل کند. اگرچه بیماری ژنتیکی کبد در برخی موارد کشنده است، انجام آزمایش ژنتیکی در صورت وجود سابقه بیماری ژنتیکی میتواند به تشخیص بیماری کمک کند. این امر از تاخیر در تشخیص بیماری جلوگیری میکند و با درمان مناسب برای زندگی طولانی سالم شروع میشود. از آنجایی که منشاء بیماری به دلایل ژنتیکی است، نمیتوان از آن پیشگیری کرد.
با درمان مناسب، هموکروماتوز و بیماری کمبود آلفا-1 آنتی تریپسین معمولا کشنده نیستند. با این حال، عوارض مرتبط با بیماری ها می تواند باشد. بسیار مهم است که افراد مبتلا به بیماری های ارثی کبدی تمام تلاش خود را برای حفظ سلامتی خود انجام دهند. پس بهتر است در صورت بروز هر گونه علائم مربوط به بیماری های کبدی هر چه سریع تر به یک متخصص داخلی یا گوارش مراجعه کنید.

![[doctor_data type='name']](https://pezeshket.com/wp-content/uploads/2025/11/69acf4a1-8afa-4c6a-ba1d-4d717d6609cc.webp)